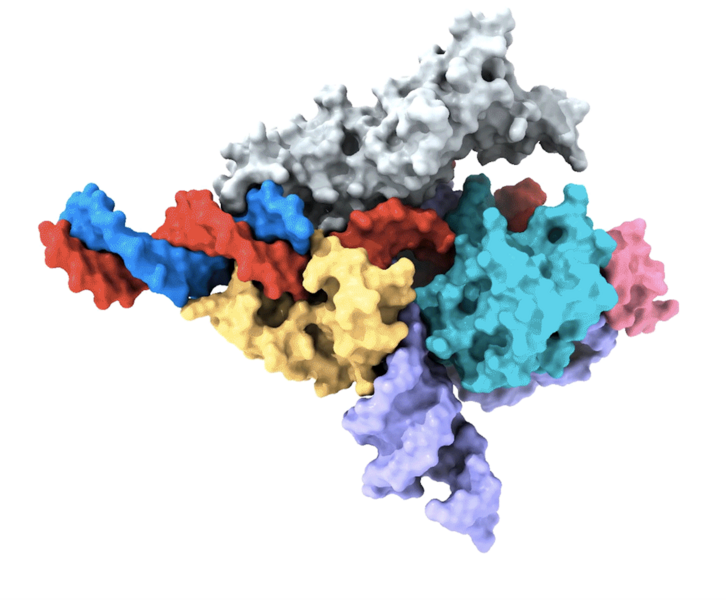
图中是fanzor蛋白(灰色、黄色、浅蓝色和粉色)与ωrna(紫色)及其目标dna(红色)复合的冷冻电镜图。非目标dna链呈蓝色。图片来源:麻省理工学院
科技日报记者 张佳欣
美国麻省理工学院麦戈文脑研究所、麻省理工学院博德研究所和哈佛大学张锋团队在真核生物中发现了第一个可编程的rna引导系统。29日发表于《自然》杂志上的论文称,这种基于fanzor蛋白的系统能对人类基因组进行编辑,类似于crispr的基因编辑系统。与crispr-cas系统相比,fanzor蛋白系统更精准,有望成为被递送至人类细胞的新型基因编辑工具。
研究表明,rna引导的dna切割机制存在于包括真核生物在内的所有生命王国。张锋表示,这个新系统是对人类细胞进行精确改变的另一种方式,补充了已有的基因组编辑工具。
两年前,团队成员在原核生物中发现了一类名为omega的rna可编程系统,这种系统通常与细菌基因组中的转座元件或“跳跃基因”相关联,并可能产生crispr-cas系统。这项研究还突显了原核生物omega系统和真核生物中fanzor蛋白之间的相似之处,表明fanzor蛋白可能也使用rna引导的机制来靶向和切割dna。
在这项研究中,研究人员从真菌、藻类和变形虫物种以及北圆蛤中均分离出fanzor蛋白。fanzor蛋白的生化特征研究结果表明,它们是切割dna的核酸内切酶,使用附近的非编码rna(即ωrna)来靶向基因组中的特定位置。这是第一次在动物等真核生物中发现这种机制。
进一步研究发现,fanzor蛋白可对人类细胞基因组的特定位点进行靶向的插入与缺失编辑,证明了fanzor蛋白作为基因组编辑工具的潜力。
研究人员通过工程化技术,在蛋白质中引入了一系列突变,使其活性增加了10倍。此外,fanzor蛋白没有显示出“附带活性”,即当rna引导内切酶切割dna时,会同时降解邻近的dna或rna。这些结果表明,fanzor蛋白有可能被开发为高效的基因组编辑程序。


